Odpověď
Na první pohled se zdá dost paradoxní, chcete-li řešit problémy s kyselinou chlorovodíkovou ze žaludku roztokem kyseliny citronové. Kupodivu to však funguje.
Pojďme se podívat jak.
Pálení žáhy vzniká zpětným průnikem kyselé tráveniny ze žaludku do jícnu, kde chybí ochranný hlen. Tento takzvaný reflux může být důsledkem ochabnutí dolního svěrače jícnu, zvýšené produkce kyseliny chlorovodíkové v žaludku po nevhodném jídle (například tučná strava, čerstvé pečivo, ostré koření, cibule, česnek), přeplnění žaludku a u tlouštíků také důsledkem tlaku břišního tuku na žaludek.
Kyselé prostředí žaludku je u masožravců a všežravců fyziologicky nezbytné, protože podporuje denaturaci bílkovin a spouští činnost enzymů – především pepsinu, jímž začíná rozklad bílkovin v potravě.
Kyselina chlorovodíková (HCl), která kyselost žaludeční šťávy zajišťuje, patří mezi silné kyseliny. Všechny její molekuly se ve vodném prostředí rozpadají (disociují) na protony H+ a chloridové anionty Cl−. Za kyselost jsou odpovědné právě protony – nebo přesněji hydroxoniové ionty H3O+.
HCl → H+ + Cl−, respektive HCl + H2O → H3 O+ + Cl−
Kyselinu chlorovodíkovou produkují v žaludku takzvané parietální výstelkové slizniční buňky. Koncentrace protonů dosahuje nalačno kolem 30 mmol/l (milimolů na litr), což formálně vyjadřuje pokles pH z neutrální hodnoty pro vodu (7,0) až k hodnotám okolo 1,5. Silná vrstva hlenu chrání stěny žaludku před kyselým poškozením a proti působení pepsinu.
 Příčný řez žaludeční sliznicí. Barvený mikroskopický preparát. Zdroj Wikimedia Commons, autor Nephron, licence CC BY-SA 3.0.
Příčný řez žaludeční sliznicí. Barvený mikroskopický preparát. Zdroj Wikimedia Commons, autor Nephron, licence CC BY-SA 3.0.Kyselina citronová, která je někdy doporučovaná proti pálení žáhy, je takzvaná slabá kyselina. Z celkového počtu jejích molekul uvolňuje protony jen menší část. Většina molekul této trikarboxylové kyseliny zůstává v rozpustné, ale nedisociované – tedy nerozpadlé – formě.
Ve vodném prostředí se díky chemickým vlastnostem slabých kyselin vytvoří zcela konkrétní a pro každou kyselinu charakteristický stav takzvané acidobazické rovnováhy. U kyseliny citronové v koncentraci 1 mmol/l v něm například připadá na 100 nedisociovaných molekul asi 18 molekul „rozpadlých“, které se disociovaly na protony H+ a záporné citrátové anionty Citr−.
Poměr součinu koncentrací uvolněného kationtu H+ a citrátového aniontu k nedisociované kyselině (která se nepodílí na kyselosti) vyjadřuje disociační konstanta Ka. Její hodnota představuje jakousi „výrobní značku“ každé slabé kyseliny. Můžeme ji záporně logaritmovat a vyjádřit pak kyselost jako pKa , podobně jako vyjadřujeme pH vody.
Hranaté závorky v této rovnici označují koncentrace látek v molech na litr:
Disociační konstanta Ka = [H+] . [Citr−] / [HCitr]
Hodnota pKa je u chemicky čisté kyseliny citronové ve vodě vyšší, než je pH žaludeční šťávy (to bývá kolem 1,5). Kyselina citronová o srovnatelné molární koncentraci jako HCl v žaludku je asi tisíckrát méně kyselá. V přírodních zdrojích, jako jsou citrony a jiné citrusové plody, se nadto vyskytuje ještě jiná, méně kyselá „příbuzná“ kyseliny citronové – isocitrát. Je veledůležitý, protože se v energetickém metabolismu buněk účastní postupného spalování cukrů a tuků. Isocitrát má pKa až 6,4 a je tedy jen desetkrát kyselejší než naše krev (ta má pH 7,4).
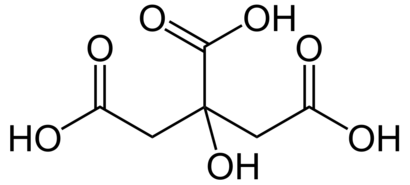
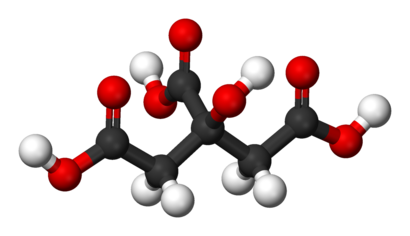 Vzorec a model molekuly kyseliny citronové. V modelu jsou černě znázorněny atomy uhlíku, bíle vodíku a červeně kyslíku. Zdroj Wikimedia Commons, autoři NEUROtiker a Benjah-bmm27, volné dílo / Public Domain.
Vzorec a model molekuly kyseliny citronové. V modelu jsou černě znázorněny atomy uhlíku, bíle vodíku a červeně kyslíku. Zdroj Wikimedia Commons, autoři NEUROtiker a Benjah-bmm27, volné dílo / Public Domain.Je zajímavé, že analyticky prověřovaný poměr citrátu a isocitrátu v komerčních citrusových nápojích slouží kontrolním potravinářským orgánům jako test, jestli nebyla do výrobku přimíchána umělá kyselina citronová. Ta se průmyslově vyrábí ve velkém měřítku z plísně Aspergillus niger. Takto získaná kyselina citronová se používá jako konzervant a nese v potravinách označení E330.
Je mnohem lacinější než přírodní kyselina, je však zdravotně méně příznivá. Mimo jiné i proto, že kvasný produkt vzniklý činností plísně je filtrován, kyselina citronová je z výsledného roztoku vysrážena pomocí hydroxidu vápenatého a ze vzniklé vápenaté soli se získá pomocí kyseliny sírové.
Kyselina citronová a její soli (citráty) fungují jako nárazníkový roztok, takzvaný pufr. Výbornou vlastností mnoha slabých kyselin je „snaha“ udržet určitý stupeň kyselosti, tedy určitou hodnotu pH roztoku. Molekuly se snaží, aby součin koncentrací volných disociovaných protonů a aniontů („tělíček“ kyselin, zde je to Citr−) byl konstantní, daný hodnotou pKa. Slabé kyseliny se tedy osvědčují jako jakýsi nárazník udržující pH při změnách koncentrace H+ – ať už protonů ubývá, nebo přibývá.
Co se stane, když citronová šťáva sjede do žaludku, kde je přebytek H+? Nadbytečné protony (H+) se okamžitě navazují na citrátové ionty (Citr−) za vzniku nových neutrálních molekul kyseliny citronové (HCitr). Celková kyselost v žaludku trochu poklesne a pH se snaží přiblížit hodnotě pKa pro citrát. Nakolik se to povede, závisí na poměru koncentrací kyselé „paní domácí“ – HCl – a méně kyselého nového „nájemníka“ – citrátu.
 Krystaly kyseliny citronové v polarizačním mikroskopu. Zdroj Wikimedia Commons, autor Jan Homann, volné dílo / Public Domain.
Krystaly kyseliny citronové v polarizačním mikroskopu. Zdroj Wikimedia Commons, autor Jan Homann, volné dílo / Public Domain.To je tedy stručné a zdaleka ne úplné teoretické vysvětlení, jak můžeme snížit kyselost žaludku pitím citronové šťávy, když nás pálí žáha. Zkušenosti ovšem ukazují, že zatímco u někoho potíže zmizí, u jiných lidí citronáda nebo oranžáda pálení ve spodní části jícnu naopak vyvolá či zesílí.
Každý z nás má zřejmě jinak citlivou výstelku jícnu (epitel), která už může být naleptána silnou kyselinou chlorovodíkovou při refluxu. Pak stačí k podráždění i slabá organická kyselina, jako je kyselina citronová.
Mimochodem, nápoj s vymačkaným citronem patří k nejzdravějším. Mimo dodávky vitaminu C a isocitrátu poskytuje bioflavonoidy, pektin, vonné silice, vitaminy skupiny B, beta-karoteny a celou řadu minerálů – vápník, draslík, fosfor, hořčík, železo, zinek a další. Prý pomáhá i při nadváze a působí protiskleroticky.
 Citrony obsahují nejen kyselinu citronovou, ale také mnoho látek, které prospívají našemu zdraví. Zdroj Wikimedia Commons, autor André Karwath, licence CC BY-SA 2.5.
Citrony obsahují nejen kyselinu citronovou, ale také mnoho látek, které prospívají našemu zdraví. Zdroj Wikimedia Commons, autor André Karwath, licence CC BY-SA 2.5.Schopnost slabých kyselin udržovat určitou optimální kyselost (pufrovat) je využívána v organické chemii a biochemii, kde některé reakce potřebují vhodné pH. Jeho hodnotu si můžeme přednastavit fosfátovými, citrátovými nebo hydrogenuhličitanovými pufračními roztoky, kde se mimo vlastní kyseliny požívají ještě jejich soli.
Úplně stejně se udržuje pH i v našem těle. pH krve je určováno především hydrogenuhličitanem a oxidem uhličitým, který reaguje s vodou za tvorby kyseliny uhličité (H2CO3). Tato kyselina, osvěžující naše smysly v perlivých sodových vodách, může disociovat s pKa = 6,3. Její zásaditá sůl hydrogenuhličitan sodný (NaHCO3), kterého bývá v krvi až 20× víc než samotné H2CO3, dotahuje pH krve na žádaných 7,4.
Tento systém může rychle kompenzovat metabolické nebo respirační výkyvy kyselosti (acidózy a alkalózy) – třeba při rychlém běhu, kdy se do krve dostává kyselina mléčná, nebo při úporném dávení, kdy ubývá „kyselých“ protonů nejen ze žaludku, ale následně i z krve. pH krve nebo moči řídí také ledviny, které mohou přebytečné protonové ekvivalenty vylučovat do moči, jejíž pH bývá kolem 6,4 a může kolísat mezi 4,5 a 8,0.
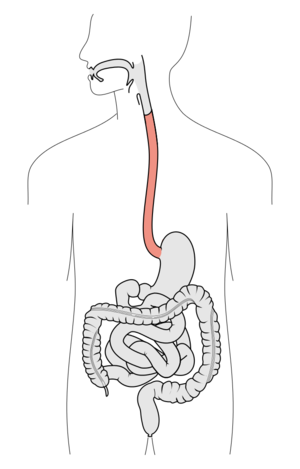 Schéma lidské trávicí soustavy. Červeně je vyznačen jícen. Zdroj Wikimedia Commons, autor Olek Remesz, licence CC BY-SA 2.5.
Schéma lidské trávicí soustavy. Červeně je vyznačen jícen. Zdroj Wikimedia Commons, autor Olek Remesz, licence CC BY-SA 2.5.Když je pálení žáhy časté a několikaměsíční, je třeba reflux léčit. Mimo úpravu životního stylu a stravování (nejíst vleže a těsně před spaním) lze používat takzvaná antacida, která kyselost neutralizují. Jde o zásadité látky, jako uhličitan vápenatý, hořečnato-hlinitý hydrotalcit nebo nejčastěji a už po 2 000 let používanou jedlou sodu (hydrogenuhličitan sodný neboli bikarbonát).
Jedlá soda působí prakticky okamžitě, ale po chvilkové neutralizaci protonů může jejich vylučování naopak zvýšit a také zatěžuje tělo nadbytečným sodíkem. Mně se osvědčuje přidat k hydrogenuhličitanu sodnému asi desetinu hydrogenuhličitanu draselného, aby poměr Na:K více odpovídal situaci v těle.
Do rukou lékaře patří posouzení, zda a nakolik snížit kyselost farmakologickým blokováním produkce protonů v žaludku. Často se používají inhibitory protonové pumpy (omeprazol), nebo následně blokátory histaminových H2 receptorů, jako je například ranitidin.
Komplikované acidobazické poměry v lidském trávicím traktu možná odrážejí smutný fakt, že za mnoha našimi trávicími problémy stojí pravěké maminy, které poprvé současně upekly na stejném rozpáleném kameni osolenou pšeničnou placku a voňavou kančí kýtu pro svého šikovného lovce a kupu dětiček, vesele čmárajících v jeskyni po stěnách docela slušné obrázky.
https://www.prirodovedci.cz/zeptejte-se-prirodovedcu/997
…s láskou a úsměvem…