Davida A. Sinclaira (54, „Konec stárnutí“), který je jedním z autorů studie.
Do omlazovacích koktejlů vědci mimo jiné přimíchali určité bílkoviny a butyrát sodný, který je palivem pro střevní buňky.
Pokud princip funguje, a on opravdu funguje, tělo už nekopíruje své stárnoucí buňky, ale pouze mladé, zdravé. Tímto způsobem se obnovuje zevnitř.
„Omlazení zvrácením věku lze dosáhnout nejen genetickými, ale i „chemickými prostředky.“ Výzkumník v oblasti stárnutí David A. Sinclair až dosud předpokládal, že nejlepším přístupem k zastavení stárnutí je genová terapie.
„Jak chemické koktejly obnovují integritu buněčného jádra a rozdělení proteinů, bych mohl poskytnout.
Jako člověk praktikující tento způsob již “ 27 let“ a jsem starší 75 let.
Pro zlepšení vašeho zdravotního stavu s ne-mocí souvisejícími s věkem.“
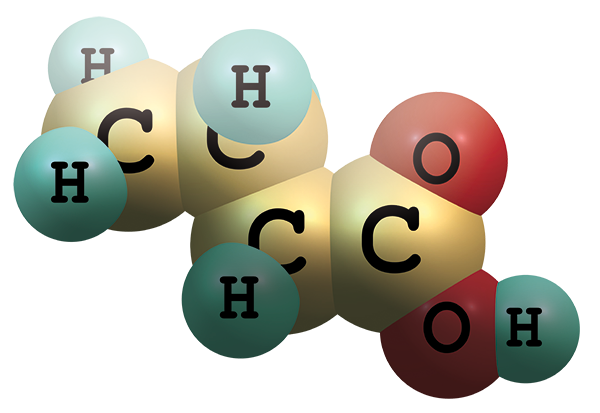
Butyrát hraje zásadní úlohu ve výživě epiteliálních buněk střeva, udržování pH střevního obsahu a v neposlední řadě může také také ovlivňovat regulaci, proliferaci, diferenciaci a apoptózu střevních buněk.Molekula butyrátu se skládá ze tří atomů uhlíku a zbytku kyseliny karboxylové. Hlavními producenty butyrátu ve střevě jsou bakterie druhu Faecalibacterium prausnitzi nebo Eubacterium rectale.
Schopnost butyrátu podporovat proliferaci normálních buněk a u nádorových indukovat diferenciaci či apoptózu je nazývána butyrátovým paradoxem (Lupton 2004). Předpokladem pro správný účinek butyrátu je jeho dostatečný příjem. Ten se uskutečňuje skrze specializované transportéry. Jeden z nich, SLC5A8, byl popsán jako nádorový supresorový gen, jehož exprese je potlačena až u 60 % nádorů (Li et al. 2003).
Butyrát reguluje buněčné procesy spojené s odbouráváním volných radikálů. Mechanizmus, který by za tuto regulaci mohl být zodpovědný, je butyrátem kontrolována zvýšená exprese detoxikačních enzymů, mezi které patří glutation-S-transferáza. Díky tomu může butyrát chránit buňky před poškozením DNA reaktivními kyslíkovými metabolity, zejména H2O2 (Hamer et al. 2008). Butyrát tak může sloužit i jako primární chemoprevence (Scheppach and Weiler 2004).
Butyrát ovlivňuje také transkripci genů pro některé cytokiny, včetně genů pro komponenty signálních drah zapojených do procesu zánětu. Dochází k inhibici aktivace signální dráhy NF-κβ, produkce interferonu γ a zvýšení exprese receptoru aktivovaného peroxizomovými proliferátory γ (PPARγ) (Hamer et al. 2008, Fung et al. 2012). Tyto vlastnosti předurčují butyrát pro využití v léčbě zánětlivého onemocnění střeva (Van Immerseel et al. 2010). Disbióza v těchto onemocněních hraje velkou roli, protože bylo prokázáno, že pacienti s ulcerózní kolitidou mají výrazně snížený výskyt butyrát produkujících bakterií Roseburia inulinivorans a Faecalibacterium prausnitzii (Machiels et al. 2014).
Butyrát zřejmě hraje svoji úlohu i ve zmírňování příznaků atopického ekzému. Vědci charakterizovali mikrobiom u 6-ti měsíčních dětí, které trpěly tímto onemocněním. Závažnost postižení ekzémem nepřímo korelovala s mikrobiální diverzitou a s množstvím bakterií produkujících butyrát.
Butyrát podporuje těsná spojení střevního epitelu a tím pomáhá zajišťovat bariérovou funkci střeva v obraně před patogeny (Plöger et al. 2012).
Je známým faktem, že strava bohatá na vlákninu pomáhá chránit před obezitou a rezistencí na inzulín. V nedávné metagenomické studii vědci zjistili, že obézní lidé mají výrazně snížený počet bakterií produkujících butyrát (Qin et al. 2012).
Diabetes I. je spjat s velmi nízkým věkem nástupu onemocnění. Ještě před tím však dochází k vytvoření autoprotilátek proti β buňkám Langerhansových ostrůvků pankreatu, které produkují inzulin. Dětem ve věku 6 měsíců byl analyzován střevní mikrobiom a rozdělení dětí podle těchto výsledků odhalilo propojení mezi stravou, mikrobiomem a vývojem autoprotilátek. Jedna skupina dětí vykazovala velký výskyt bakterií rodu Akkermansia a méně Bacterioides. Druhá skupina kojenců, u které převažovaly bakterie rodu Bacterioides, byla charakteristická brzkým zavedením bez mléčné stravy, zvýšeným rizikem vytvoření autoprotilátek proti β buňkám Langerhansových ostrůvků pankreatu a zároveň nižším výskytem genů pro produkci butyrátu. Na základě těchto výsledků vytvořili vědci hypotézu, že butyrát má ochranou funkci před vývojem autoprotilátek proti β buňkám Langerhansových ostrůvků pankreatu a tím pádem i před rozvinutím diabetu I. (Endesfelder et al. 2016).
Butyrát byl vyhodnocen jako potenciální přístup v léčbě cystické fibrózy (Zeitlin 2000). Zdá se, že exprese funkčního chloridového transportéru CFTR (cystic fibrosis transmembrane conductance regulator) může být znovu obnovena pomocí butyrátu. Proces zatím není plně objasněn, ale zřejmě zahrnuje modulaci transkripční hladiny a správné poskládání CRFT proteinu (Zeitlin 2000). Na X chromozom vázaná adrenoleukodystrofie je porucha lipidového metabolizmu, projevující akumulací nevětvených mastných kyselin s velmi dlouhým řetězcem.
Její příčinou je mutace ABCD1 genu pro lipidový transportér. Inhibitory HDAC, jako butyrát, snižují oxidativní poškození tkáně a navíc, jsou schopné kompenzovat nedostatek funkčního ABCD2 u pacientů s tímto onemocněním (Berger et al. 2010).
Butyrát má dlouhodobý přínos při ischemickém poškození a zřejmě proto najde uplatnění v léčbě cévní mozkové příhody. Preklinická studie ukazuje, že léčba butyrátem stimuluje proliferaci, migraci a diferenciaci buněk u potkanů vystavených permanentní cerebrální ischemii (Kim, Leeds and Chuang 2009).
Butyrát má velmi silný neuroprotektivní efekt u transgenního myšího modelu Huntingtonovy choroby a zdá se tedy být velmi slibným terapeutickým přístupem v léčbě tohoto onemocnění. Mutantní Huntingtnův protein reaguje s transkripčními faktory, což vede ke snížené acetylaci histonů. Podávání phenylbutyrátu při prvním nástupu symptomů onemocnění vede ke zmírnění atrofie neuronů a prodloužení života transgenních myší (Gardian et al. 2005).
Další zajímavý efekt butyrátu je jeho vliv na paměť. Blokování aktivity HDAC ovlivňuje synaptickou plasticitu a paměť, což naznačuje, že HDAC mohou sloužit k návratu chromatinu do represivního stavu a mohou umlčovat transkripci potřebnou pro tvorbu dlouhodobé paměti. HDAC mohou sloužit jako zásadní supresorové geny pro paměť a inhibitory HDAC, jako butyrát, mohou pomoci generovat mnohem trvalejší formy dlouhodobé paměti, což otevírá zcela nový terapeutický potenciál butyrátu (Vecsey et al. 2007).
Butyrat
Viele der momentan in klinischen Studien untersuchten HDAC-Inhibitoren sind synthetische Stoffe, die eine erhöhte Aktivität aufweisen. HDAC-Inhibitoren sind jedoch keineswegs eine Neuerfindung des Menschen, sondern werden von verschiedenen Mikroorganismen auch natürlich produziert. Trichostatin A (TSA) wurde beispielsweise von dem Bakterium Streptomyces hygroscopicus isoliert und zunächst als fungistatisches Antibiotikum beschrieben. Auch entsteht im Kolon des Menschen durch bakterielle Fermentierung von Ballaststoffen Butyrat, für welches eine Vielzahl von positiven Eigenschaften auf die Darmhomöostase nachgewiesen wurde, die nicht zuletzt auf dessen Aktivität als HDAC-Inhibitor zurückzuführen sind. So stärkt Butyrat die Darmbarriere, moduliert das intestinale Immunsystem und wirkt entzündungs – sowie krebshemmend. Zusätzlich wurde in zahlreichen Studien die Wirkung von Butyrat auch außerhalb des Darms untersucht. Neben zahlreicher weiterer biochemischer Eigenschaften stellte sich heraus, dass Butyrat nicht nur das Wachstum verschiedenster Krebszellen hemmt, sondern auch das Knochenwachstum, die Neurogenese bei ischämischen Gehirnschäden sowie die fetale Hämoglobinexpression in hämatologischen Erkrankungen, wie Thalassämie oder Sichelzellanämie, anregen kann. Jedoch ist der systemische therapeutische Nutzen von Butyrat durch dessen unvorteilhafte pharmakologische Eigenschaften, wie der kurzen Halbwertszeit im Organismus und dem sofortigen Abbau in der Leber, stark eingeschränkt, was jedoch auch für lokale Anwendungen, wie für chronisch-entzündliche Darmerkrankungen (CED), Vorteile bietet.
Schulthess et al. aus dem Labor von Fiona Powrie konnten kürzlich in einer prä-klinischen Studie aufklären, wie Butyrat über die Inhibition von HDAC3 die Makrophagenfunktion im Kontext von CED beeinflussen kann, indem insbesondere Stoffwechsel- und Transkriptionsänderungen in den Makrophagen induziert werden, wodurch deren bakterizide Funktionen verbessert werden. Es ist bereits bekannt, dass HDAC3-defiziente Makrophagen nach Stimulation mit IL-4 stärker in Richtung eines M2-Phänotyps polarisieren und dass Makrophagen nach Gabe von Klasse-1-HDAC-Inhibitoren IL- 4 – hypersensitiv werden. Diese Funktionen sind jedoch kontextabhängig und treten nur auf, wenn tatsächliche IL-4-Signale vorliegen. Bisher ging man davon aus, dass der Großteil der Wirkung der HDAC3-Hemmung mit der dauerhaften Acetylierung der nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB) – Untereinheit p65 und der dadurch hervorgerufenen Hemmung von NF-κB erklärt werden kann. Schulthess et al. ergänzen und erweitern frühere Studien, indem sie zeigen, dass Butyrat durch seine Funktion als HDAC3-Inhibitor auch die Differenzierung eines spezialisierten antimikrobiellen Makrophagenphänotyps induziert, wenn die entzündliche Zytokinproduktion nicht verändert wird. Es ergibt sich ein Modell, in dem Butyrat ein antiinflammatorisches und antimikrobielles Programm in Makrophagen induziert, welches die intestinale Homöostase fördert. Dies hat weitreichende Konsequenzen, legen epidemiologische Studien doch nahe, dass eine Exposition in jungen Jahren gegenüber Antibiotika einen Risikofaktor für CED darstellt und Breitbandantibiotika zumindest in Modellsystemen Butyratmangel und Dysfunktionen von auf Butyrat reagierenden Makrophagen und T-Zellen verursachen. Die Wiederherstellung der antimikrobiellen Funktion in Darmmakrophagen mittels Butyrat könnte daher ein universeller Mechanismus zur Prävention oder Therapie von CED sein, aber auch Auswirkungen auf (Darm)Infektionen haben. Es bleibt abzuwarten, ob selektive HDAC3-Inhibitoren einen Vorteil gegenüber ihrem natürlichen Gegenstück Butyrat haben. In der Tat könnte die HDAC3-Hemmung auch weitere, bisher unbekannte Auswirkungen auf zusätzliche Zelltypen des Darms sowie anderer Organe haben.
Resveratrol Sirtuin 500 Pro s Piper nigrum Resveratrol Sirtuin 500 pro vysoké dávky s 500 mg čistého rostlinného Trans-resveratrolu (stupeň čistoty 98 %) a s 5 mg vysoce kvalitního extraktu Piper nigrum (95% Piperin) na kapsli. Antioxidanty doplněk stravy na rostlinné bázi japonské křídlatky.
Doplňující Piperin s jinými přírodními látkami ukázal, že jsou lépe absorbovány tělem. Trans-Resveratrol s 98% stupněm čistoty obohacený cenným extraktem Piper nigrum (Pipein 95% alkaloidy) může působit jako multiplikátor biologické dostupnosti. Čistý přírodní Trans-Resveratrol (3,5,4 Trihydroxystilben) ve vysokých dávkách 500 mg v jedné tobolce. 100% Resveratrol, přírodní rostlinný extrakt s vysokou biologickou dostupností. Resveratrol, stejně jako další cenné fytochemikálie, patří mezi polyfenoly.
Resveratrol podle Dr. med. Michalzik obsahuje velmi vysoký podíl přírodního resveratrolu, takže pro koncentraci resveratrolu nejsou nutné žádné složité postupy. To zajišťuje vyšší kvalitu, protože Resveratrol je chráněn před oxidací. Má vysokou biologickou dostupnost. Léková forma v přírodním rostlinném extraktu chrání před oxidací, takže ve své aktivní formě je tělu k dispozici s vysokou biologickou dostupností.
Resveratrol Sirtuin 500 Pro jako doplněk stravy: 500 mg čistého Trans-resveratrolu (stupeň čistoty 98 %) 5 mg extraktu Piper nigrum (Extrakt z černého pepře) Aktivní Látky: 3,4,5 Trihydroxystilben (Trans-Resveratrol) Piperin 95% Alkaloidy Všechny složky jsou kontrolovány zbytky, bez maziv, jako jsou hořčíkové soli, mastné kyseliny a podobně. Bez Lepku, Bez Želatiny, Bez Laktózy, Bez Změkčovadel.
Doporučené dávkování/denní dávka doplněk stravy: užívejte denně 1 Resveratrol Sirtuin 500 v kapsli s dostatečným množstvím tekutiny po jídle.
Resveratrol Sirtuin 500 PRO vhodný pro vegany a vegetariány! Složení: Resveratrol 98% stupeň čistoty a rostlinného původu (Polygonum cuspidatum), Piper nigrum Extrakt (Extrakt z černého pepře) Materiál tobolky / Obal tobolky: hydroxypropylmethylcelulosa, celulosa čistě rostlinná Obsah balení: 60 vegetariánských kapslí, 39,06 G e Výrobce: Biotikon Deutschland Wintergasse 144 D-69469 Weinheim Upozornění: nepřekračujte doporučenou denní dávku.
Doplňky stravy nejsou určeny jako náhrada pestré a vyvážené stravy a zdravého životního stylu. Užívání u dětí, těhotných a kojících pouze po konzultaci s lékařem. Uchovávejte mimo dosah dětí, v suchu, chladu, chráněné před světlem a těsně uzavřené. Po otevření spotřebujte.
Máte zájem? Pošlete Email!
…s láskou a úsměvem…